Faisal Azhar
Senin, 08 April 2013
Ini Cerita ku Apa Cerita mu ?? :) Slideshow Slideshow
Ini Cerita ku Apa Cerita mu ?? :) Slideshow Slideshow: TripAdvisor™ TripWow ★ Ini Cerita ku Apa Cerita mu ?? :) Slideshow Slideshow ★ untuk Banda Aceh, Medan and Aceh Tenggara (near Berastagi). Slideshow perjalanan gratis yang menakjubkan di TripAdvisor
Sabtu, 23 Maret 2013
Makalah Ilmu Mikrobiologi Enumerasi Bakteri
BAB I
PENDAHULUAN
I.1 Latar Belakang
Di dalam bidang ilmu mikrobiologi ada suatu hal
mendasar yang juga perlu diperhatikan yaitu analisia kualitatif terhadap suatu
bahan. Suatu analisis ini Sangat penting untuk mengetahui jumlah mikroorganisme
yang ada pada suatu sampel tertentu mengandung banyak mikroorganisme atau
sebaliknya (Ferdiaz, 1992). Analisis kualitatif atau biasa disebut dengan
enumerasi mikroorganisme dalam hal ini dapat dilakukan baik dengan perhitungan
langsung terhadap suatu sampel yaitu salah satunya dengan alat bantu mikroskop,
maupun dengan cara tidak langsung yaitu dengan beberapa metode perhitungan
(Gobel, 2008).
Dalam percobaan ini akan dibahas secara lebih lanjut
mengenai bagaimana cara perhitungan jumlah sel yang ada di dalam suatu medium
yang mana umumnya digunakan untuk uji mikrobiologi bahan pangan yaitu metode
hitung cawan (Total Plate Counts ) dan metode hitung MPN (Most Probable
Number). Sedangkan untuk metode perhitungan secara langsung dapat kita terapkan
pada sampel pengujian salinitaasi lingkungan sehingga dengan demikian
diharapkan kita akan lebih memahami tentang bagaimana prosedur perhitungan yang
baik.
I.2 Tujuan Percobaan
Adapun tujuan dari percobaan ini adalah :
1.
Untuk mengetahui perhitungan mikroorganisme dengan metode Standar Plate
Count (SPC) pada medium Nutrien Agar (NA).
2.
Untuk mengetahui perhitungan mikroorganisme dengan metode Most Probable
Number (MPN) pada medium Laktosa Broth (LB).
I.3 Waktu dan Tempat
Percobaan
Praktikum ini dilaksanakan pada hari Rabu, 01 April 2009, pukul 14.00-
17.30 WITA dan bertempat di Laboratorium Mikrobiologi, Jurusan Biologi,
Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Hasanuddin,
Makassar.
BAB II
TINJAUAN PUSTAKA
Istilah pertumbuhan umumnya dipergunakan bakteri dan
mikroorganisme yang lainnya dan biasanya lebih mengacu pada perubahan di dalam
hasil panen sel dan bukanlah dilihat. Dari pertambahan jumlah individu
mikroorganisme tersebut. Suatu proses pertumbuhan menyatakan pertambahan jumlah
atau massa yang melebihi dari yang ada di dalam inokulum asalnya (Volk, 1985).
Sebelum kita dapat mengevaluasi atau menafsirkan
respon pertumbuhan bakteri dalam berbagai media atau pada kondisi yang berbeda-
beda kita harus menyatakan pertumbuhan secara kualitatif. Di dalam bidang ilmu
mikrobiologi, istilah pertumbuhan ini ditafsirkan dalam berbagai cara. Sebagai
contoh mungkin dalm suatu perangkat tertentu dari kondisi pembiakan di nilai
sama sebaiknya karena bakteri melakukan pertumbuhan yang relatif cepat pada
stadium awal, tetapi panen sel total akhirnya belum tentu sebanyak yang di
dspat pada perangkat yang lainnya (Pelczar, 1986).
Tersedia banyak teknik di dalam laboratorium untuk
mengukur pertumbuhan bakteri tersebut. Alat- alat yang ada tersebut berkisar
dari peralatan yang masih sederhana seperti sebuah kaca objek dengan olesan
yang diwarnai. Selain itu terdapat pula metode- metode yang lain dalam
pengukuran pertumbuhan bakteri, misalnya dengan metode hitung cawan, pengukuran
kekeruhan dari suatu suspensi, pengukuran dengan menggunakan membran atau
filter molekuler dan penentuan berat (Volk, 1985).
Suatu bakteri dapat dihitung secara elektronik yaitu
dengan cara memasukkan biakan melalui lubang yang sangat kecil pada alat
penghitung partikel counter. Alat penghitung yang semacam ini dapat dipakai
secara rutin memecah sel darah, namun dapat pula disesuaikan untuk memecah
bakteri (Volk, 1985). Akan tetapi, bukanlah laju pertumbuhan bakteri yang tepat
melainkan ada atau tidaknya pertumbuhan bakteri yang akan menjadi perhatian.
Adapun cara yang dilakukan untuk menentukannya, yaitu hanyalah dengan melihat
biakan. Suatu medium cair akan berubah menjadi keruh sedangkan medium yang
padat paada umumnya akan memperlihatkan pertumbuhan, baik itu pada permukaan dari
medium maupun di dalam medium tersebut (Hadioetomo, 1996).
Penetapan jumlah bakteri di dalam suatu populasi
bakteri mungkin saja akan mengalami hambatan. Hal ini karena tidak semua sel
yang ada di dalam suatu biakan itu mampu untuk hidup secara trus- menerus. Jadi
dalam perhitungan ini maka yang dianggap sebagai sel hidup adalah sel yang
membentuk koloni di dalam medium biakan atau dapat juga digunakan bakteri yang
mampu membentuk suspensi di dalam medium biakan. Sel- sel yang mampu hidup
terus adalah yang dihitung dengan berbagai metode untuk menetapkan jumlah
selnya. Pada jumlah total sel, maka ikut dihitung semua sel yang tampak atau
yang dapat dihitung dengan cara yang lainnya, sehingga dengan demikian sel-sel
mati dan cacat akan ikut terhitung (Indra, 2008).
Untuk menentukan jumlah bakteri yang ada di dalam
suatu medium maka dapat digunakan beberapa cara sebagai berikut (Lay, 1994):
·
Jumlah bakteri secara keseluruhan (total cell counts). Pada cara ini di
hitung semua bakteri yang ada di dalam suatu medium biakan baik yang hidup
maupun yang mati.
·
Jumlah bakteri8 yang hidup (Viable count). Cara ini hanya menggambarkan
jumlah sel yang hidup saja, sehingga lebih tepat jika dibandingkan dengan cara
yang pertama tadi.
Koloni yang tumbuh di dalam suatu medium itu tidaklah
selalu berasal dari satu sel mikroorganisme, karena beberapa mikroorganisme
tertentu cenderung untuk berkelompok atau berabtai. Bila ditumbuhkan pada suatu
medium dengan lingkungan yang sesuai, maka kelompok bakteri ini hanya akan
menghasilkan satu koloni saja. Berdasarkan hal tersebut sering kali digunakan
istilah Colony Forming Units (CFU) yang digunakan untuk perhitungan jumlah
mikroorganisme hidup (Dwidjoseputro, 1996).
Dalam perhitungan jumlah mikroorganisme ini seringkali
digunakan pengenceran. Di dalam laboratorium, pengenceran di lakukan dengan
botol pengenceran seperti lazimnya pada SPC, namun dapat pula menggunakan
tabung reaksi. Pada pengenceran dengan menggunakan botol cairan terlebih dahulu
dikocok dengan baik sehingga kelompok sel dapat terpisah. Pengenceran sel dapat
membantu untuk memperoleh perhitungan jumlah mikroorganisme yang benar. Namun
pengenceran yang terlalu tinggi akan menghasilkan lempengan agar dengan jumlah
koloni yang umumnya relatif rendah (Hadioetomo, !996).
Pada metode perhitungan cawan dilakukan pengenceran
yang bertingkat yang mana ditujukan untuk membentuk konsentrasi dari suatu
suspensi bakteri. Sampel yang telah di encerkan ini di hitung ke dalam cawan
baru kemudian di tuang ke mediumnya (metode tuang). Kemudian setelah diinkubasi
selama 24- 48 jam, amati koloni yang tumbuh dan koloni yanng diamati hanyalah
koloni yang berjumlah 30- 300 koloni (Gobel, 2008).
Adapun prinsip dari metode hitung cawan ini adalah
jika sel jasad renik yang masih hidup ditumbuhkan pada suatu medium agar, maka
sel jasad renik tersebut akan berkembang biak dan membentuk koloni yang dapat
di lihat langsung dan dihitung dengan mata tanpa menggunakan alat bantu seperti
mikroskop dan sebagainya. Metode hittung cawan ini merupakan cara yang paling
sensitif untuk menentukan jumlah jassad renik karena beberapa hal yaitu
(Ferdiaz, 1992):
·
Hanya sel yang masih hidup yang dihitung
·
Beberapa jenis jasad renik dapat dihitung sekaligus
·
Dapat digunakan untuk mengisolasi dan identifikasi jasad renik karena
koloni yang terbentuk mungkin berasal dari suatu jassad renik yang mempunyai
penampakan yang spesifik.
Untuk metode MPN (Most probable number) digunakan
medium cair dalam wadah berupa tabung reaksi, perhitungan di lakukan
bwerdasarkan jumlah tabung yang positif yaitu tabung yang mengalami perubahan
pada mediumnya baik itu berupa perubahan warna atau terbentuknya gelembung gas
pada dasar tabung durham. Pada metode perhitungan MPN ini digunakan bentuk tiga
seri pengenceran, yang pertama 10 ¹, 10 ², dan 10 ³. Kemudian dari hasil
perubahan tersebut dicari nilai MPNnya pada tabel nilai MPN, dan untuk jumlah
bakterinya maka digunakan rumus (Gobel, 2008).
Bakteri = nilai MPN x 1/pengenceran tengah
Selain dengan cara tidak langsung seperti yang telah
dijelaskan di atas, perhitungan jumlah mikroorganisme di dalm suatu medium
dapat juga dilakukan secara langsung, dimana dengan metode ini jumlah
mikroorganisme tersebut dapat ditentukan langsung dengan menggunakn alat bantu
berupa mikroskop, Colony counter dan hemasitometer. Adapun keuntungan
penggunaan hemasitometer adalah penggunaannya yang tidak memakan waktu banyak
dan juga biaya. Sedangkan kelemahan dari penggunaan hemasitometer adalah tidak
dapat membedakan antara sel hidup dan sel mati, kesulitan dalam perhitungan
bakteri yang berukuran kecil karena tidak dapat dibantu dengan minyak imersi,
hanya dapat dibantu dengan tween 80%(bahan anti gumpal (Gobel, 2008).
BAB III
METODE KERJA
METODE KERJA
III. 1 Alat
Alat yang digunakan pada percobaan ini yaitu : Timbangan
Ohaus, Sendok tanduk, Tabung reaksi, Tabung durham, Rak tabung, Spoit, Botolpengencer,
Bunsen, Erlenmeyer, Autoklaf, Enkas, Cawanpetri,
Inkubator, Batang pengaduk, Penangas
III.2 Bahan
Bahan yang digunakan dalam percobaan ini yaitu :
Tanah,Alumunium foil,Aquadest steril,Kertas label,Alkohol 70 %,Korek api,Tissu
roll,Medium LB (Laktosa Broth),Medium NA (NUtrien Agar)
III.3 Prosedur Kerja
A. Metode MPN (Most Probable Number)
1.
Menyiapkan 9 tabung reaksi yang berisi medium Laktosa Broth (LB), kemudian
member label untuk masing-masing pengenceran dan menyiapkan 3 buah tabug reaksi
pada setiap pengenceran.
2.
Membuat pengenceran susprnsi bakteri yang berasal dari suspense tanah
hingga pengenceran 10-7.
3.
Memasukkan masimg-masing seri pengenceran 10-1, 10-2 dan 10-3 sebanyak 1 mL
kedalam tabung yang berisi medium Laktosa Broth. C selama 24-48 jam dan
mengamatiâ4. Menginkubasi pada suhu 37 perubahan yang terjadi.
4.
Mencatat dan menghitung MPN (Most Probable Number).
B. Metode SPC (Standar Plate Count).
1.
Menyediakan 3 capet steril.
2.
Membuat pengenceran suspensi bakteri yang berasal dari suspense tanah
hingga pengenceran 10-7.
3.
Menanam suspensi tanah dengan metode tuang kedalam capet steril mulai dari
pengenceran 10-5, 10-6 dan 10-7.
4.
Menginkubasi semua cawan pada suhu 370 C selama 24-48 jam.â
5.
Mengamati dan menghitung jumlah koloni yang tumbuh pada setiap pengenceran
dan hitung SPC dari koloni tersebut.
B. Metode
MPN (Most Probable Number).
Pada percobaan ini menggunakan sampel berupa suspense
tanah untuk mengetahui adanya mikroba / bakteri yang ditandai dengan
terbentuknya gas, perubahan warna dan terbentuknya endapan. Digunakan tabung
durham untuk menampung gas hasil fermentasi mikroorganisme dari bakteri
coliform. Pengenceran yang digunakan yaitu 10-1. 10-2 dan 10-3 . Dari hasil
pengamatan diperoleh semua tabung ditumbuhi mikroorganisme karena memiliki
tanda-tanda diantaranya terdapat perubahan warna yakni dari agak hijau menjadi
kuning, tabung durham melayang akibat 24,00 dan jumlahmdihasilkannya gas
dan terdapat endapan. Diperoleh MPN sebesar 10. Dapat disimpulkan
bahwa bakteri masih hidup apabila% 2,4 msel bakteri konsentrasi
pengenceran tergolong tinggi. Fungsi dari media Laktosa Broth yaitu untuk
mengetahui adanya bakteri coliform.
C.
Metode SPC (Standar
Plate Count).
Pada percobaan ini menggunakan pengenceran 10-5, 10-6
dan 10-7 dan. Digunakan cawan petri untuk menumbuhkan mikroba. Dari hasil
pengamatan diperoleh pada cawan petri 10-5 terdapat 6 koloni bakteri yang
tumbuh sedangkan pada cawan petri 10-6 dan 10-7 tidak ditumbuhi bakteri. Dapat
disimpulkan bahwa konsentrasi pengenceran yang terlalu tinggi menyebabkan
bakteri yang tumbuh hanya sedikit bahkan tidak ada sama sekali.
BAB IV
PENUTUP
IV.1 Kesimpulan
Berdasarkan percobaan dapat disimpulkan bahwa :
1.
Standar Plate count didasarkan pada asumsi bahwa setiap sel mikroorganisme
hidup dalam suspensi akan tumbuh menjadi satu koloni setelah ditumbuhkan dalam
media pertumbuhan dan lingkungan yang sesuai.
2.
MPN didasarkan pada metode statistik (teori kemungkinan).
3.
Nilai SPC yang diperoleh berdasarkan m 10-5, sedangkan nilai MPN
yang diperoleh yaitu %percobaan yaitu 6,0 24,00.
IV.2 Saran
Saran untuk laboratorium agar percobaan berikutnya keanekaragaman bakteri
yang digunakan dapat bertambah lagi sehingga hasil yang diperoleh dapat
bervariasi serta fasilitas lebih ditambah lagi.
DAFTAR PUSTAKA
Dwidjoseputro, S., 1992, Mikrobiologi Pangan, Gramedia Pustaka
Utama, Jakarta.
Ferdias, S., 1992, Mikrobiologi Pangan, Gramedia Pustaka Utama, Jakarta.
Gobel, Risco, B., dkk.,
2008, Mikrobiologi Umum Dalam Praktek,
Universitas Hasanuddin, Makassar.
Hadioetomo, R., 1990, Mikrobiologi Dasar-Dasar Dalam Praktek,
Gramedia, Jakarta.
Indra., 2008,
http//ekmon-saurus/bab-5-Morfologi-mikroba/.htm . diakses pada tanggal 08
maret 2009, Makassar.
Lay, B., 1994, Analisis Mikroba di Laboratorium, Raja
Grafindo Persada, Jakarta.
Pelczar, Michael, J.,
1986, Dasar- Dasar Mikrobiologi, Universitas
Indonesia, Jakarta.
Volk, dan Wheeler.,
1993, Dasar- Dasar Mikrobiologi,
Erlangga, Jakarta.
Alasan Kenapa Pesawat Bisa Terbang
Alasan Kenapa Pesawat Bisa
Terbang
1. Tekanan Atmosfir
Meskipun banyak sekali macamnya tekanan, diskusi ini terutama berisi tentang tekanan atmosfir. Tekanan atmosfir ini adalah faktor penting dari perubahan cuaca, membantu mengangkat pesawat, dan menggerakkan beberapa instrumen penerbangan penting dalam pesawat udara.
Instrumen-instrumen ini adalah altimeter (penunjuk ketinggian), indikator airspeed (kecepatan udara), indikator rate-of-climb (kecepatan menanjak), dan penunjuk tekanan manifold. Meskipun udara sangat rin
gan, tapi memiliki massa dan dipengaruhi oleh gaya gravitasi. Maka, udara juga seperti halnya benda lain, memiliki berat dan memiliki gaya. Karena udara merupakan zat cair, maka gaya yang dimilikinya bekerja secara sama-rata ke semua arah, dan efek gayanya pada udara disebut tekanan (pressure). Pada kondisi baku di permukaan laut, rata-rata tekanan yang diterima pada tubuh manusia oleh atmosfir adalah sekitar 14,7 pon/inci. Kepadatan udara mempunyai efek yang berarti pada kemampuan pesawat terbang. Jika udara berkurang kepadatannya maka akan berakibat berkurangnya:
tenaga, karena mesin mendapatkan udara yang lebih sedikit,
thrust (gaya dorong) karena efisiensi baling-baling menjadi berkurang pada udara tipis,
lift (gaya angkat) karena udara tipis memberikan gaya yang lebih sedikit pada airfoil.
2. THRUST
Sebelum pesawat mulai bergerak, thrust harus digunakan. Pesawat akan tetap bergerak dan bertambah kecepatannya sampai thrust dan drag menjadi sama besar. Untuk menjaga kecepatan yang tetap maka thrust dan drag harus tetap sama, seperti halnya lift dan weight harus sama untuk mempertahankan ketinggian yang tetap dari pesawat. Jika dalam penerbangan yang datar (level), gaya thrust dikurangi, maka pesawat akan melambat. Selama thrust lebih kecil dari drag, maka pesawat akan terus melambat sampai kecepatan pesawat (airspeed) tidak sanggup lagi menahan pesawat di udara. Sebaliknya jika tenaga mesin ditambah, thrust akan menjadi lebih besar dari drag, pesawat terus menambah kecepatannya. Ketika drag sama dengan thrust, pesawat akan terbang dengan kecepatan yang tetap.
Terbang straight dan level (lurus dan datar) dapat dipertahankan mulai dari terbang dengan kecepatan rendah sampai dengan kecepatan tinggi. Penerbang harus mengatur angle of attack dan thrust dalam semua jangkauan kecepatan (speed regim) jika pesawat harus ditahan di ketinggian tertentu (level flight).
Secara kasar jangkauan kecepatan ini dapat dikelompokkan dalam 3 daerah (regim), kecepatan rendah (low-speed), menjelajah (cruising flight), dan kecepatan tinggi (high-speed).
3. DRAG
Drag atau hambatan dalam penerbangan terdiri dari dua jenis: parasite drag dan induced drag. Yang pertama disebut parasite drag karena tidak ada fungsinya sama sekali untuk membantu pesawat untuk dapat terbang, sedangkan yang kedua disebut induced karena dihasilkan atau terbuat dari hasil kerja sayap yang membuat gaya angkat (lift).
4. WEIGHT
Gravitasi adalah gaya tarik yang menarik semua benda ke pusat bumi. Center of gravity (CG) bisa dikatakan sebagai titik di mana semua berat pesawat terpusat. Pesawat akan seimbang di keadaan/attitude apapun jika pesawat terbang ditahan tepat di titik center of gravity. Center of gravity juga adalah sesuatu yang sangat penting karena posisinya sangat berpengaruh pada kestabilan sebuah pesawat terbang.
5. LIFT
Penerbang dapat mengendalikan lift. Jika penerbang menggerakkan roda kemudi ke depan atau belakang, maka angle of attack akan berubah. Jika angle of attack bertambah maka lift akan bertambah (jika faktor lain tetap konstan). Ketika pesawat mencapai angle of attack yang maksimum, maka lift akan hilang dengan cepat. Ini yang disebut dengan stalling angle of attack atau burble point.
6.Sumbu gerakan pesawat
Pada saat pesawat yang sedang terbang mengubah sikap (attitude) atau posisi, pesawat tersebut berputar pada salah satu sumbu atau lebih, dari 3 sumbu yang merupakan garis khayal yang melewati Center of Gravity dari pesawat. Sumbu-sumbu dari pesawat bisa dianggap sebagai poros khayal tempat pesawat berputar, seperti halnya poros/gandar tempat roda berputar. Di titik di mana ketiga poros bersilangan, masing-masing pada 90° terhadap kedua poros lainnya. Sumbu yang memanjang sepanjang badan pesawat dari hidung pesawat sampai ekor, adalah sumbu longitudinal. Sumbu yang memotong dari ujung sayap ke ujung sayap yang lainnya disebut sumbu lateral. Sumbu yang tegak melewati center of gravity, adalah sumbu vertikal.
Pergerakan pesawat pada sumbu longitudinal menyerupai gerakan mengguling kapal dari satu sisi ke sisi yang lain. Bahkan sebenarnya nama-nama yang aslinya digunakan dalam istilah yang berhubungan dengan transportasi kelautan. Istilah-istilah ini telah diserap dalam istilah-istilah aeronautika karena persamaan gerakan antara sebuah pesawat terbang dengan sebuah kapal laut.
Dalam adopsi dari istilah kelautan, gerakan pesawat pada sumbu longitudinalnya disebut “roll”/guling, gerakan pada sumbu lateral disebut “pitch”/angguk. Akhirnya, sebuah pesawat bergerak pada sumbu vertikal yang disebut “yaw”/belok, yaitu, gerakan horisontal (kiri dan kanan) dari hidung pesawat.
Drag atau hambatan dalam penerbangan terdiri dari dua jenis: parasite drag dan induced drag. Yang pertama disebut parasite drag karena tidak ada fungsinya sama sekali untuk membantu pesawat untuk dapat terbang, sedangkan yang kedua disebut induced karena dihasilkan atau terbuat dari hasil kerja sayap yang membuat gaya angkat (lift).
4. WEIGHT
Gravitasi adalah gaya tarik yang menarik semua benda ke pusat bumi. Center of gravity (CG) bisa dikatakan sebagai titik di mana semua berat pesawat terpusat. Pesawat akan seimbang di keadaan/attitude apapun jika pesawat terbang ditahan tepat di titik center of gravity. Center of gravity juga adalah sesuatu yang sangat penting karena posisinya sangat berpengaruh pada kestabilan sebuah pesawat terbang.
5. LIFT
Penerbang dapat mengendalikan lift. Jika penerbang menggerakkan roda kemudi ke depan atau belakang, maka angle of attack akan berubah. Jika angle of attack bertambah maka lift akan bertambah (jika faktor lain tetap konstan). Ketika pesawat mencapai angle of attack yang maksimum, maka lift akan hilang dengan cepat. Ini yang disebut dengan stalling angle of attack atau burble point.
6.Sumbu gerakan pesawat
Pada saat pesawat yang sedang terbang mengubah sikap (attitude) atau posisi, pesawat tersebut berputar pada salah satu sumbu atau lebih, dari 3 sumbu yang merupakan garis khayal yang melewati Center of Gravity dari pesawat. Sumbu-sumbu dari pesawat bisa dianggap sebagai poros khayal tempat pesawat berputar, seperti halnya poros/gandar tempat roda berputar. Di titik di mana ketiga poros bersilangan, masing-masing pada 90° terhadap kedua poros lainnya. Sumbu yang memanjang sepanjang badan pesawat dari hidung pesawat sampai ekor, adalah sumbu longitudinal. Sumbu yang memotong dari ujung sayap ke ujung sayap yang lainnya disebut sumbu lateral. Sumbu yang tegak melewati center of gravity, adalah sumbu vertikal.
Pergerakan pesawat pada sumbu longitudinal menyerupai gerakan mengguling kapal dari satu sisi ke sisi yang lain. Bahkan sebenarnya nama-nama yang aslinya digunakan dalam istilah yang berhubungan dengan transportasi kelautan. Istilah-istilah ini telah diserap dalam istilah-istilah aeronautika karena persamaan gerakan antara sebuah pesawat terbang dengan sebuah kapal laut.
Dalam adopsi dari istilah kelautan, gerakan pesawat pada sumbu longitudinalnya disebut “roll”/guling, gerakan pada sumbu lateral disebut “pitch”/angguk. Akhirnya, sebuah pesawat bergerak pada sumbu vertikal yang disebut “yaw”/belok, yaitu, gerakan horisontal (kiri dan kanan) dari hidung pesawat.
Selasa, 28 Februari 2012
Rabu, 21 Desember 2011
Penelitian Infeksi parasit pada ikan kerapu
KEJADIAN PENYAKIT INFEKSI PARASIT PADA IKAN KERAPU
DI KERAMBA JARING APUNG TELUK EKAS,
KABUPATEN LOMBOK TIMUR, NUSA TENGGARA BARAT
Fris Johnny1) , Des Roza1) dan Prisdiminggo2)
1) Balai Besar Riset Perikanan Budidaya Laut Gondol, Bali PO BOX 140 , Singaraja 81101 Bali
2) Balai Pengkajian Teknologi Pertanian Nusa Tenggara Barat PO BOX 1017 Mataram 87010 Mataram
ABSTRACT
The groupers cultured on net cages have developed at Ekas Bay
Keywords: parasitic diseases, groupers, net cage, Ekas Bay
ABSTRAK
Upaya budidaya ikan kerapu di keramba jaring apung telah dikembangkan oleh Balai Pengkajian Teknologi Pertanian, NTB di Teluk Ekas, Kabupaten Lombok Timur, NTB. Ikan kerapu yang telah dibudidayakan adalah jenis ikan kerapu bebek, Cromileptes altivelis, ikan kerapu macan, Epinephelus fuscoguttatus,dan ikan kerapu lumpur, Epinephelus coioides. Penelitian untuk mengetahui jenis parasit yang menginfeksi ikan kerapu di keramba jaring apung telah dilakukan di Laboratorium Patologi Balai Besar Riset Perikanan Budidaya Laut Gondol, Bali . Sampel parasit diidentifikasi dengan pengamatan langsung secara mikroskopis terhadap preparat segar dari insang dan parasit yang diperoleh melalui perendaman ikan dalam air tawar. Hasil pengamatan menunjukkan bahwa parasit yang menginfeksi ikan kerapu adalah Neobenedenia, Diplectanum dan Haliotrema.
Kata kunci: penyakit infeksi, parasit, ikan kerapu, keramba jaring apung, Teluk Ekas
PENDAHULUAN
Budidaya ikan kerapu pada beberapa lokasi di Indonesia Bali bagian utara telah semakin berkembang dan mampu menjamin pasokan benih. Pada awalnya benih ikan kerapu sangat mengandalkan pasokan alam yang jumlahnya sangat terbatas dan waktu pasok yang tidak menentu. Karena itu pemerintah mendorong segala upaya yang mengarah kepada kegiatan budidaya ikan kerapu khususnya melalui jaring apung di laut (Subiyanto et al., 2001).
Usaha budidaya laut merupakan salah satu usaha yang dapat memberikan alternatif sumber penghasilan untuk meningkatkan pendapatan bagi nelayan. Apabila usaha budidaya berkembang, maka produksi ikan dapat ditingkatkan baik jumlah maupun mutunya. Dampak lebih lanjut dari usaha ini adalah kesejahteraan masyarakat nelayan mengalami peningkatan (Akbar, 2001).
Balai Pengkajian Teknologi Pertanian, NTB telah mencoba mengembangkan keramba jaring apung di Teluk Ekas, Desa Batunampar, Lombok Timur, NTB. Usaha budidaya ikan kerapu di keramba jaring apung yang dikembangkan adalah jenis ikan kerapu bebek, Cromileptes altivelis, ikan kerapu macan, Epinephelus fuscoguttatus, dan ikan kerapu Lumpur, Epinephelus coioides. Pengembangan usaha budidaya ikan kerapu di keramba jaring apung mempunyai kelebihan antara lain rendahnya biaya operasional dibandingkan dengan nilai ekonomi yang dihasilkan serta teknologi budidayanya yang relatif sederhana dan mudah diadaptasikan di masyarakat petani nelayan secara luas.
Salah satu permasalahan yang timbul pada budidaya ikan kerapu di keramba jaring apung adalah terjadinya penyakit. Kematian ikan kerapu di keramba jaring apung dan induk ikan kerapu di panti benih merupakan kendala yang sering dihadapi. Pada ikan kerapu yang mati biasanya banyak ditemukan parasit, baik pada insang, kulit, maupun mata. Ikan kerapu yang dibudidayakan pada keramba jaring apung pada kondisi kepadatan tinggi, dan jaring kotor serta jarang diganti dan dibersihkan, memacu kecepatan perkembangbiakan organisme parasit dan penyakit sehingga dapat merugikan inang, bahkan dapat menyebabkan kematian.
Leong (1994) melaporkan infeksi parasit pada ikan kerapu dan ikan kakap telah dilaporkan oleh di Malaysia
Penelitian ini bertujuan untuk mengidentifikasi bakteri yang menginfeksi ikan kerapu di keramba jaring apung.
METODE
Ikan Uji
Ikan uji adalah ikan kerapu yang dibudidayakan di dalam keramba jaring apung di Teluk Ekas, Lombok Timur, NTB. Jenis ikan kerapu yang diuji yaitu; ikan kerapu bebek, Cromileptes altivelis, ikan kerapu macan, Epinephelus fuscoguttatus, dan ikan kerapu Lumpur, Epinephelus coioides dengan bobot antara 80 – 240 gram.
Identifikasi Parasit
Pertama, dilakukan pemotongan sedikit lamella insang, diletakkan pada kaca slide dan diamati serta diidentifikasi secara langsung dengan menggunakan mikroskop. Kedua, sampel parasit diperoleh dengan cara merendam ikan kerapu dalam air tawar selama 10-15 menit sampai parasit yang menempel pada ikan terlepas. Parasit yang terlepas selanjutnya dikumpulkan dalam botol, sebagian diamati dan diidentifikasi secara langsung melalui mikroskop, sebagian sampel diawetkan dalam buffer formalin. Identifikasi parasit dilakukan secara mikroskopis terhadap preparat segar dan preparat awetan berdasarkan Grabda (1991).
HASIL DAN PEMBAHASAN
Dari ikan kerapu yang dibudidayakan di dalam keramba jaring apung di Teluk Ekas, Lombok Timur, NTB, parasit yang umum ditemukan menginfeksi ikan kerapu adalah dari klas Trematoda Monogenea yaitu; Neobenedenia, Diplectanum, dan Haliotrema.
Parasit Neobenedenia
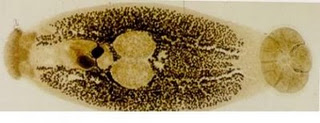
Dari ikan kerapu yang direndam dengan air tawar selama 10-15 menit setelah diidentifikasi sesuai dengan metoda Grabda (1991) ditemukan parasit Neobenedenia (Gambar 1). Parasit ini termasuk Ordo Dactylogyridea, Famili Capsilidae. Monogenean Capsalid dikenal sebagai cacing kulit dan merupakan parasit eksternal yang paling umum pada budidaya ikan laut. Capsalid meliputi beberapa spesies dan mempunyai kesamaan morphologi yaitu berbentuk oval (lonjong) dan gepeng dengan sepasang sucker bulat (anterior sucker) pada tepi bagian depan dan sebuah haptor besar (opisthapthor) pada tepi bagian belakang. Di Balai Besar Riset Perikanan Budidaya Laut Gondol, telah ditemukan beberapa jenis Capsalid yang didapat dari induk ikan-ikan kerapu, ikan napoleon dan ikan kakap. Capsalid yang ditemukan pada ikan kerapu bebek telah diidentifikasi sebagai Neobenedenia girellae dan Benedenia epinepheli. Neobenedenia girellae mempunyai tingkat patogenisitas yang lebih tinggi dibandingkan dengan Benedenia epinepheli, karena Neobenedenia girellae selain dapat menginfeksi kulit juga menyerang mata yang menyebabkan kebutaan. Ikan kerapu yang terinfeksi Neobenedenia girellae memperlihatkan gejala klinis; kehilangan nafsu makan, tingkah laku berenangnya lemah dan adanya perlukaan karena infeksi sekunder bakteri. Secara spesifik terlihat adanya mata putih keruh, yang menimbulkan kebutaan yang disebabkan oleh infeksi bakteri. Sebaliknya jenis Capsalid yang lain tidak meyebabkan mata putih keruh pada ikan yang teinfeksi. Capsalid merupakan parasit yang tidak berwarna yang ada di permukaan badan ikan, sehingga sangat sulit untuk mengetahui adanya infeksi parasit. Untuk itu, merendamkan ikan beberapa menit dalam air tawar adalah cara yang sangat mudah untuk mengetahui adanya infeksi karena parasit akan segera berubah warna menjadi putih didalam air tawar tersebut. Upaya pengendalian terhadap infeksi parasit ini, dianjurkan merendam dalam air tawar selama 10-15 menit atau dalam H2O2 150 ppm selama 30 menit (Zafran et al., 1997; Zafran et al., 1998; Koesharyani et al., 2001).
Gambar 1. Parasit Neobedenia yang menginfeksi ikan kerapu
Gambar. Proses infeksi pada ikan
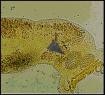
Parasit Diplectanum
Dari pengamatan secara mikroskopis terhadap sayatan segar lamella insang ikan kerapu menggunakan mikroskop, setelah diidentifikasi parasit pada insang ikan kerapu tersebut diketahui sebagai Diplectanum (Gambar 2). Parasit Diplectanum termasuk Ordo Dactylogyridea, Famili Diplectanidae dan dikenal sebagai parasit Monogenetik trematoda insang. Parasit Diplectanum disebut juga cacing insang, merupakan parasit yang cukup berbahaya dan sering ditemukan pada ikan laut. Beberapa jenis parasit insang dapat menyebabkan kematian yang cukup serius pada ikan yang dibudidaya . Parasit Diplectanum mempunyai kekhasan yang membedakannya dari spesies lain dalam Ordo Dactylogyridea yaitu mempunyai squamodisc (satu di ventral dan satu di dorsal), dan sepasang jangkar yang terletak berjauhan (Zafran et al., 1997). Parasit Diplectanum adalah parasit yang hidup pada insang ikan. Ikan kerapu yang terinfeksi Diplectanum terlihat bernapas lebih cepat dengan tutup insang yang selalu terbuka. Infeksi Diplectanum mempunyai hubungan erat dengan penyakit sistemik seperti vibriosis. Insang yang terinfeksi biasanya berwarna pucat dan produksi lendirnya berlebihan (Chong & Chao, 1986). Ikan kerapu yang terinfeksi memperlihatkan gejala klinis; menurunnya nafsu makan, tingkah laku berenang yang abnormal pada permukaan air, warna tubuh berubah menjadi pucat. Serangan berat dari parasit ini dapat merusak filamen insang dan kadang-kadang dapat menimbulkan kematian karena adanya gangguan pernapasan. Warna insang ikan kerapu yang terinfeksi terlihat pucat. Upaya pengendaliannya dapat dilakukan dengan perendaman 250 ppm formalin selama 1 jam atau perendaman dalam air laut salinitas tinggi yaitu 60 ppt selama 15 menit (Zafran et al., 1998; Koesharyani et al., 2001).
Gambar 2. Parasit Diplectanum
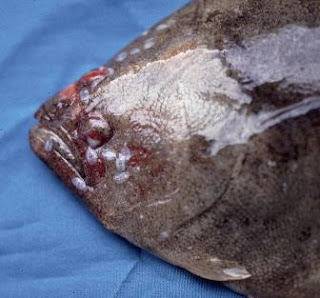
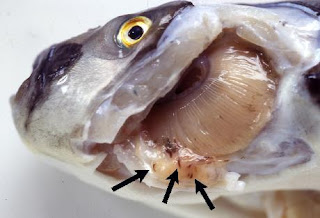
Parasit Haliotrema
Parasit ini termasuk Ordo Dactylogyridea, Famili Diplectanidae dan dikenal sebagai parasit Monogenetik trematoda insang. Parasit Haliotrema (Gambar 3) disebut juga cacing insang, merupakan parasit yang cukup berbahaya dan sering ditemukan pada ikan laut. Seperti parasit Diplectanum, parasit ini juga diidentifikasi dari preparat segar insang secara mikroskopis menggunakan mikroskop. Parasit ini dapat diidentifikasikan berdasarkan bentuk karakteristik morfologinya. Di Balai Besar Riset Perikanan Budidaya Laut Gondol, jenis Haliotrema sp., adalah salah satu jenis parasit insang penyebab kematian masal pada ikan kerapu bebek (Zafran et al., 1998). Ikan kerapu yang terinfeksi memperlihatkan gejala klinis; menurunnya nafsu makan, tingkah laku berenang yang abnormal pada permukaan air, warna tubuh berubah menjadi pucat. Serangan berat dari parasit ini dapat merusak filamen insang dan kadang-kadang dapat menimbulkan kematian karena adanya gangguan pernapasan. Warna insang ikan kerapu yang terinfeksi terlihat pucat. Upaya pengendaliannya dapat dilakukan dengan perendaman 250 ppm formalin selama 1 jam atau perendaman dalam air laut salinitas tinggi yaitu 60 ppt selama 15 menit (Zafran et al., 1998; Koesharyani et al., 2001).
Gambar 3. Infeksi parasit Haliotrema pada filamen insang.
Siklus hidup parasit Monogenea, Neobenedenia, Diplectanum, dan Haliotrema adalah dengan menghasilkan telur yang dilengkapi dengan filamen panjang yang berfungsi untuk menempel pada substrat. Dalam waktu sekitar lima
KESIMPULAN
Jenis parasit yang ditemukan menginfeksi ikan kerapu budidaya pada keramba jaring apung di Teluk Ekas, Lombok Timur, NTB adalah Neobenedenia, Diplectanum, dan Haliotrema.
DAFTAR PUSTAKA
Akbar, S. 2001. Pembesaran Ikan Kerapu Bebek (Cromileptes altivelis) dan Kerapu Macan (Epinephelus fuscoguttatus) di Karamba Jaring Apung. (In) Aliah et al., (Eds) Prosiding Lokakarya Nasional Pengembangan Agribisnis Kerapu, Jakarta
Bondad-Reantaso, M.G., K. Ogawa, M. Fukudome, and H. Wakabayashi. 1995. Reproduction and Growth of Neobenedenia girellae (Monogenea: Capsalidae), a Skin Parasite of Cultured Marine Fishes of Japan. Fish Pathology, 30(3):227-231.
Chong, Y.C. and T.M. Chao. 1986. Common Diseases of Marine Foodfish. Fisheries Handbook No. 2. Primary Production Departement. Ministry of National Development. Republic of Singapore
Grabda, J. 1991. Marine Fish Parasitology. Polish Scientific Publisher. Warsawa. 306p.
Koesharyani, I. , D. Roza, K. Mahardika, F. Johnny, Zafran and K. Yuasa. 2001. Marine Fish and Crustaceans Diseases in Indonesia
Leong, T.S. 1994. Parasites and Diseases of Cultured Marine Finfish in South East Asia . School of Biological Malaysia
Ogawa, K.M., M.G. Bondad-Reantaso, M. Fukudome and H. Wakabayashi. 1995. Neobenedenia girellae (Hargis, 1955) Yamaguti, 1963 (Monogenea: Capsalidae) From Cultured Marine Fishes of Japan. J. Parasitology. 81(2):223-227.
Subiyanto, I. Adisuko, S. Anwar, N. Yustiningsih, S. Prayitno, dan P. Sumardika. 2001. Pengkajian dan Pengembangan Usaha Budidaya Ikan Kerapu Nasional. (In) Aliah et al., (Eds) Prosiding Lokakarya Nasional Pengembangan Agribisnis Kerapu, Jakarta
Zafran, I. Koesharyani dan K. Yuasa. 1997. Parasit Pada Ikan Kerapu di Panti Benih dan Upaya Penanggulangannya. Jurnal Penelitian Perikanan Indonesia
Zafran, D. Roza, I. Koesharyani, F. Johnny and K. Yuasa. 1998. Marine Fish and Crustaceans Diseases in Indonesia
DISKUSI
Pertanyaan:
1. Dimana penentuan jenis penyakit pada ikan kerapu bisa dianalisa?
2. Bagaimana mengatasi penyakit virus pada budidaya ikan kerapu dalam KJA
Tanggapan :
1. Untuk analisa penyakit bisa dilakukan di laboratorium BBRBP Gondol, BBAP Situbondo, dan Loka Budidaya Laut Gerupuk.
2. Virus belum ada obatnya sementara hanya pencegahan saja.
- VNN bisa di treat dengan OTC.
- Irridovirus belum terlihat di Ekas.
3. Usaha-usaha yang dilakukan
- Penerbitan leaflet tentang panduan pengendalian penyakit virus dengan bahasa yang mudah dipahami nelayan.
Langganan:
Postingan (Atom)